「睡眠驅力來自於粒線體融合」修訂間的差異
| (未顯示同一使用者於中間所作的 17 次修訂) | |||
| 行 1: | 行 1: | ||
| − | [[分類:生命科學]] | + | [[分類:生命科學]][[分類:重磅材料]] |
# 《Nature》雜誌 2025.7.16 發佈了題為《睡眠驅力來自於粒線體融合》(Mitochondrial origins of the pressure to sleep)的研究報告。 | # 《Nature》雜誌 2025.7.16 發佈了題為《睡眠驅力來自於粒線體融合》(Mitochondrial origins of the pressure to sleep)的研究報告。 | ||
| − | # <span style='vertical-align:top'>[https://www.youtube.com/@Jiu111 久不利多]製作的播客解說影片:<embedvideo service='jendo' w='480' h='360'>http://urclass.net/files/wikiUsed/原來我們為了粒線體才需要睡覺!最新Nature研究.mp4</embedvideo></span> | + | # <span style='vertical-align:top'>[https://www.youtube.com/@Jiu111 久不利多]製作的播客解說影片:(來源:[https://www.youtube.com/watch?v=mMgjlIC-VqQ Youtube])<embedvideo service='jendo' w='480' h='360'>http://urclass.net/files/wikiUsed/原來我們為了粒線體才需要睡覺!最新Nature研究.mp4</embedvideo></span> |
| 行 77: | 行 77: | ||
這些證據共同描繪了一幅清晰的圖景:在清醒時,dFBNs 處於一種能量「過飽和」狀態。電子源源不斷地涌入,卻沒有足夠的 ATP 需求來消耗它們,導致電子傳遞鏈「超載」。這種超載狀態就像一個不斷被充氣的氣球,其內部的「壓力」——也就是電子泄漏和 ROS 損傷——持續累積,最終形成了我們所感知的、不可抗拒的睡眠壓力。 | 這些證據共同描繪了一幅清晰的圖景:在清醒時,dFBNs 處於一種能量「過飽和」狀態。電子源源不斷地涌入,卻沒有足夠的 ATP 需求來消耗它們,導致電子傳遞鏈「超載」。這種超載狀態就像一個不斷被充氣的氣球,其內部的「壓力」——也就是電子泄漏和 ROS 損傷——持續累積,最終形成了我們所感知的、不可抗拒的睡眠壓力。 | ||
| + | |||
| + | ====黑客帝國:重編睡眠程式的「作弊碼」==== | ||
| + | |||
| + | 如果「電子溢出」真的是睡眠壓力的根源,那麼通過人為干預這個過程,就應該能夠像輸入「作弊碼」一樣,隨心所欲地操縱睡眠。研究人員正是這麼做的,他們上演了一場精彩的「系統破解」,為自己的假說提供了因果性的證明。 | ||
| + | |||
| + | '''作弊碼一:為電子高速路開闢「應急車道」''' | ||
| + | |||
| + | 既然問題出在電子「堵車」,那麼最直接的解決辦法就是疏導交通。研究人員想到了兩種方法。第一種方法是安裝一個「安全出口」。他們利用基因工程,在 dFBNs 的線粒體中引入了一種來自海鞘 (Ciona intestinalis) 的替代氧化酶 (alternative oxidase, AOX)。這種酶非常特別,它可以繞過電子傳遞鏈的後半段,直接接收「堵車」的電子,並將它們與氧氣結合產生水。它相當於為擁堵的電子車流開闢了一條暢通無阻的應急出口,安全地釋放了交通壓力,同時又不會產生 ROS。 | ||
| + | |||
| + | 結果如何?表達了 AOX 的果蠅,其基礎睡眠時間顯著減少,並且在經歷睡眠剝奪后,它們幾乎不需要「補覺」。這表明,一旦電子溢出的問題被解決,睡眠壓力就無從積累了。第二種方法是增開「出口收費站」。研究人員在 dFBNs 中過表達了一種叫做解偶聯蛋白 (uncoupling protein, Ucp4) 的蛋白質。這種蛋白的作用是線上粒體內膜上形成一個「漏洞」,讓被泵出去的質子可以直接流回,而無需經過 ATP 合酶。這相當於人為地增加了能量消耗,迫使電子傳遞鏈必須加速運轉來維持質子梯度,從而增加了對電子的需求。結果同樣支援了假說:表達了 Ucp4 的果蠅,睡眠時間也顯著減少了。 | ||
| + | |||
| + | '''作弊碼二:製造一場「幽靈堵車」''' | ||
| + | |||
| + | 有疏導,自然也要有添堵。如果能不通過 NADH,而是用其他方式來製造 ATP,那麼原本的電子就變得「多餘」了,電子溢出的問題會更加嚴重。這會直接誘導睡眠嗎?研究人員在 dFBNs 的線粒體中安裝了一個來自古菌的光碟機動質子泵 (light-driven proton pump, delta-rhodopsin)。這個蛋白就像一個微型的太陽能電池板,只要用特定波長的光照射,它就能主動地將質子泵出線粒體內膜,建立起驅動 ATP 合成的質子梯度。這意味著,ATP 的生產可以完全繞開電子傳遞鏈。 | ||
| + | |||
| + | 實驗結果令人驚歎。當研究人員用綠光照射這些果蠅時,它們幾乎是立刻就陷入了沉睡。在光照的第一個小時內,它們的睡眠時間遠超所有對照組。這就像是憑空製造了巨大的睡眠壓力,讓果蠅不得不立即「還債」。這個實驗證明,dFEBNs 中的電子盈餘,而非能量(ATP)本身的多寡,才是誘導睡眠的關鍵訊號。 | ||
| + | |||
| + | '''作弊碼三:觀察破壞的痕跡''' | ||
| + | |||
| + | 電子溢出產生的 ROS 是具有高度破壞性的「分子流氓」,它們會優先攻擊線粒體膜上的脂質和蛋白質,對線粒體造成損傷。受損的線粒體需要被修復或清除,而這個過程的第一步,往往是線粒體分裂 (mitochondrial fission)。健康的線粒體通常呈細長的管狀網路,而受損的線粒體會斷裂成許多細小的、碎片化的球狀或桿狀結構。 | ||
| + | |||
| + | 研究人員利用高解析度的顯微鏡技術,觀察了睡眠剝奪前後 dFBNs 神經元中線粒體的形態。他們發現,經過一夜的睡眠剝奪,dFBNs 中的線粒體確實發生了顯著的碎片化:它們變得更小、更圓,數量也更多了。而當這些果蠅被允許「補覺」24小時後,它們的線粒體形態又恢復了健康的長條網路狀。更關鍵的是,這種形態上的變化與電子溢出直接相關。在那些表達了 AOX(安全出口)或被持續啟用(增加ATP消耗)的果蠅中,即使經歷了睡眠剝奪,它們 dFBNs 里的線粒體也依然保持著健康的形態,沒有發生碎片化。 | ||
| + | |||
| + | 這一系列觀察將分子層面的「電子溢出」與細胞器層面的「形態損傷」緊密地聯繫在了一起。睡眠壓力不僅是一個抽像的概念,它在 dFBNs 內部留下了清晰可見的物理傷痕——破碎的線粒體。 | ||
| + | |||
| + | ====線粒體的「分合之舞」:決定你是精神抖擻還是睡眼惺忪==== | ||
| + | |||
| + | 至此,我們已經有了一條清晰的邏輯鏈:清醒 → dFBNs 被抑制 → ATP 消耗降低 → 電子在 ETC 中「堵車」 → 電子溢出產生 ROS → 線粒體受損併發生分裂(碎片化)。現在,我們面臨最後一個,也是最核心的問題:線粒體的這種形態變化,是如何最終轉化為控制整個機體睡眠行為的命令的? | ||
| + | |||
| + | 線粒體的形態並非一成不變,而是在分裂 (fission) 和融合 (fusion) 之間進行著動態的平衡之舞。這個舞蹈由一組特殊的 GTP 酶家族蛋白精確調控。其中,Drp1 蛋白是分裂的主要執行者,它像一個項圈一樣,箍線上粒體上並收緊,最終將其「掐斷」。而 Marf 和 Opa1 蛋白則是融合的關鍵角色,它們分別負責線粒體外膜和內膜的融合,讓兩個線粒體合併成一個。 | ||
| + | |||
| + | 研究人員猜測,這場「分合之舞」本身,可能就是調節睡眠的「舞步」。如果說線粒體分裂是機體應對睡眠壓力(即電子溢出和損傷)的一種應答,那麼人為地操縱這個過程,應該也能影響睡眠。他們再次動用了基因「手術刀」,在 dFBNs 中強制改變這場舞蹈的節奏。 | ||
| + | |||
| + | 當強制分裂時:他們過量表達了分裂蛋白 Drp1,或者敲低了融合蛋白 Marf/Opa1。這相當於讓線粒體持續處於碎片化的狀態,模擬的是機體已經「還完睡眠債」並開始修復的訊號。結果出人意料卻又在情理之中:這些果蠅的睡眠時間顯著減少了,並且在睡眠剝奪后幾乎沒有睡眠反彈。這說明,線粒體分裂這個動作,本身就是一種「睡眠壓力已釋放」的訊號。通過人為製造這個訊號,系統被「欺騙」了,認為不再需要睡眠。 | ||
| + | |||
| + | 當強制融合時:反過來,他們敲低了分裂蛋白 Drp1,或者過量表達了融合蛋白 Marf 和 Opa1。這讓線粒體無法正常分裂,即使在電子溢出和 ROS 損傷不斷累積的情況下,它們也只能「硬扛」,無法啟動修復程式。結果與強制分裂完全相反:這些果蠅的睡眠時間大大增加,睡得更沉,更難被喚醒。這表明,當「壓力釋放」的訊號通路(即線粒體分裂)被阻斷時,睡眠壓力會以前所未有的程度累積,導致機體需要更長、更深的睡眠來償還這筆「巨額債務」。 | ||
| + | |||
| + | 這些實驗的結果,將線粒體的形態動態與睡眠行為直接掛鉤。但最終的聯繫點在哪裡?答案是神經元的電生理特性 (electrophysiological properties)。研究人員通過活體腦片電生理記錄,直接分析了不同狀態下 dFBNs 的「興奮性」。他們發現,線粒體的形態直接決定了神經元的放電能力: | ||
| + | |||
| + | 當線粒體強制融合時(對應高睡眠壓力、長睡眠),dFBNs 變得更易興奮。在注入相同電流的情況下,它們能產生更多、更強的動作電位爆發。而當線粒體強制分裂時(對應低睡眠壓力、短睡眠),dFBNs 的興奮性則顯著降低。 | ||
| + | |||
| + | 這便是最終的閉環:電子溢出 → 線粒體損傷與分裂 → dFBNs 興奮性降低。等等,這裡似乎有一個矛盾。我們知道,dFBNs 是睡眠誘導神經元,它的興奮(放電)是促進睡眠的。那麼,高睡眠壓力(清醒久了)應該讓它更容易興奮才對,為什麼實驗結果反而是興奮性降低呢? | ||
| + | |||
| + | 這裡的邏輯需要仔細梳理。睡眠壓力(電子溢出和線粒體分裂)本身,是一種抑制 dFBNs 功能的訊號,它讓 dFBNs 變得遲鈍,這是機體在清醒時維持覺醒狀態的機制。而睡眠的發生,是當這種壓力累積到一定閾值后,系統發生「相變」,通過某種代償機制(比如,在睡眠期間線粒體融合佔主導),使 dFBNs 的興奮性反彈並超越正常水平,從而觸發強烈的放電,引導機體進入睡眠狀態以進行修復。因此,強制融合的實驗,實際上是模擬了睡眠期間的修復狀態,使得 dFBNs 長期處於高興奮性,從而導致了過度的睡眠。而強制分裂的實驗,則是將 dFBNs 鎖定在了「壓力已釋放」的低興奮性狀態,從而減少了睡眠。 | ||
| + | |||
| + | 這場線粒體的分合之舞,就這樣通過調控神經元的興奮性,將最微觀的電子流動,最終轉換爲了整個生物體最宏觀的行為節律——睡與醒。 | ||
| + | |||
| + | ====沙漏里的電子:睡眠,一場古老的能量管理藝術==== | ||
| + | |||
| + | 現在,讓我們回到最初的問題:睡眠壓力究竟是什麼?這項研究為我們描繪了一幅前所未有的高清影象。睡眠壓力並非一種神秘的體液或單一的「睡眠因子」,它是一種發生在特定神經元(dFBNs)線粒體中的物理化學過程。它源於清醒狀態下,細胞能量供需的失衡——即電子供應(來自營養)超過了 ATP 需求(來自神經活動)。 | ||
| + | |||
| + | 這種失衡導致了電子在傳遞鏈上的「交通堵塞」,並最終以活性氧(ROS)的形式「泄漏」出來,對線粒體造成氧化損傷。作為應對,線粒體網路發生分裂和碎片化。而這個由電子溢出驅動的、伴隨著線粒體損傷和形態重塑的過程,其本身,就是睡眠壓力的物理實體。 | ||
| + | |||
| + | 研究人員在論文的最後,提出了一個極為精妙的比喻:電子在 dFBNs 呼吸鏈中的流動,就像沙子在沙漏中流動一樣。在清醒時,沙子(電子)不斷從上方(NADH)落下,但下方(ATP 需求)的出口卻很小,導致沙子在「腰部」(電子傳遞鏈)堆積。這種堆積(電子溢出)就是睡眠壓力的累積。當堆積達到極限時,唯一的解決辦法就是將沙漏整個「翻轉」過來——這就是睡眠。在睡眠中,dFBNs 開始活躍放電,ATP 需求大增,堆積的沙子得以快速流下,同時啟動線粒體的融合與修復。當沙子流完,壓力就釋放了,新的一天開始了。 | ||
| + | |||
| + | 這個模型不僅完美地解釋了該研究中的所有實驗數據,更將睡眠置於一個更宏大、更古老的生命背景之下。它告訴我們,睡眠可能並非大腦爲了處理資訊、鞏固記憶等「高級」功能而「發明」的奢侈品,而是有氧代謝 (aerobic metabolism) 這一古老生命策略不可避免的副產品。 | ||
| + | |||
| + | 有氧呼吸,即利用氧氣作為最終電子受體,能最大限度地從食物中榨取能量,這是地球生命演化史上的一次巨大飛躍,它為複雜多細胞生物的出現奠定了基礎。但凡事皆有代價。高效能量轉換的背後,是電子泄漏和 ROS 損傷的持續風險。 | ||
| + | |||
| + | 睡眠,或許就是生命爲了管理這一風險,爲了定期清理和修復能量工廠(線粒體)所演化出的終極解決方案。這也能解釋為什麼睡眠問題與許多代謝相關疾病,如神經退行性疾病、代謝綜合徵等,有著千絲萬縷的聯繫——它們的共同點,都指向了線粒體功能障礙和氧化應激。 | ||
| + | |||
| + | 從果蠅大腦深處的一群神經元,到細胞內微小的線粒體,再到奔流不息的電子,這項研究帶領我們完成了一次跨越多個尺度、激動人心的科學探索。它揭示了,驅動我們日復一日沉入夢鄉的,或許正是那流淌在生命最核心能量中樞里,如沙漏般精準計時的,無形的電子。睡眠,原來是一場如此古老而深刻的能量管理藝術。 | ||
| + | |||
| + | 版權聲明 本網站所有註明「來源:生物谷」或「來源:bioon」的文字、圖片和音視訊資料,版權均屬於生物谷網站所有。非經授權,任何媒體、網站或個人不得轉載,否則將追究法律責任。取得書面授權轉載時,須註明「來源:生物谷」。其它來源的文章系轉載文章,本網所有轉載文章系出於傳遞更多資訊之目的,轉載內容不代表本站立場。不希望被轉載的媒體或個人可與我們聯繫,我們將立即進行刪除處理。 | ||
===參考資料:=== | ===參考資料:=== | ||
# [http://jendo.org/files/wikiUsed/Mitochondrial%20origins%20of%20the%20pressure%20to%20sleep.pdf 報告],[https://www.nature.com/articles/s41586-025-09261-y.pdf Nature 官網下載點] | # [http://jendo.org/files/wikiUsed/Mitochondrial%20origins%20of%20the%20pressure%20to%20sleep.pdf 報告],[https://www.nature.com/articles/s41586-025-09261-y.pdf Nature 官網下載點] | ||
# [[zhtwwikipedia::粒線體融合|粒線體融合]] | # [[zhtwwikipedia::粒線體融合|粒線體融合]] | ||
| + | # [http://urclass.net/files/wikiUsed/meuer.pdf 神經元凋亡過程中粒線體衰變的調控(德文)],[https://ediss.uni-goettingen.de/bitstream/11858/00-1735-0000-0006-AC57-0/1/meuer.pdf 原文出處],第10頁有粒線體被 Drp1 收縮致分裂的圖示 | ||
| + | # [http://djqmfrancois.free.fr/AuP1complet/wp-content/uploads/NEMOS-Mitochondrie.pdf 粒線體](法文),第5頁有粒線體被 Drp1 收縮致分裂的圖示 | ||
| + | |||
| + | <h3>[https://www.nature.com Nature]</h3> | ||
| + | <h4>一、期刊簡介</h4> | ||
| + | <ul> | ||
| + | <li>《Nature》創刊於 1869 年,是一本國際知名、綜合型的週刊科學期刊。</li> | ||
| + | <li>出版商為 Nature Portfolio,隸屬於 Springer Nature 集團。</li> | ||
| + | </ul> | ||
| + | <h4>二、定位與宗旨</h4> | ||
| + | <ul> | ||
| + | <li>Nature 標榜「世界領先的跨學科科學期刊」:刊登具重大影響力、跨領域、原創性研究成果。</li> | ||
| + | <li>它不僅刊登研究文章,也包括評論 (Review)、專題報導、科學新聞、分析文章與社論等。Nature</li> | ||
| + | <li>其審稿與選稿標準非常嚴格:一般提交率極高、接受率低,以保證「突破性」與「廣泛影響力」為目標。</li> | ||
| + | </ul> | ||
| + | <h4>三、歷史沿革</h4> | ||
| + | <ul> | ||
| + | <li>創刊於 1869 年11月4日,由英國創立,旨在提供一個科學成果與討論的公開平台。</li> | ||
| + | <li>隨著時間推移,逐步擴展為擁有多個專門分支期刊 (例如 Nature Physics、Nature Biotechnology 等)的出版集團。</li> | ||
| + | <li>從紙本轉向網路版,並且涵蓋科研、新聞、評論、網路媒體等多種形式。</li> | ||
| + | </ul> | ||
| + | <h4>四、期刊影響 & 在學界的重要性</h4> | ||
| + | <ul> | ||
| + | <li>Nature 是全球被引用率極高的科學期刊之一,其影響力在學術界被視為極具指標性。</li> | ||
| + | <li>因為其高度競爭的審稿流程,被錄用於 Nature 的文章往往被視為「重大突破」。維基百科</li> | ||
| + | <li>儘管如此,也有學界對於高影響力期刊的可靠性、偏好性等提出批評。arXiv</li> | ||
| + | </ul> | ||
| + | <h4>五、內容與版塊特色</h4> | ||
| + | <ul> | ||
| + | <li><strong>研究論文 (Articles/Letters)</strong>:Nature 的核心內容,多為具新穎性與廣泛影響的原創科研成果。Nature</li> | ||
| + | <li><strong>新聞與評論 (News & Comment)</strong>:科學政策、資金、倫理、社會影響等議題的報導與分析。</li> | ||
| + | <li><strong>專欄與解說 (News & Views, Reviews)</strong>:對某一領域或研究進展的綜述與深入解釋。</li> | ||
| + | <li><strong>補充與拓展渠道</strong>:除了主刊以外,Nature 系列還包括多個專業子刊 (如 Nature Genetics、Nature Physics…)。維基百科</li> | ||
| + | </ul> | ||
| + | <h4>六、投稿與讀者群</h4> | ||
| + | <ul> | ||
| + | <li><strong>投稿人</strong>:主要為全球各領域(物理、生物、地球科學、醫學、材料科學等)的研究學者。</li> | ||
| + | <li><strong>讀者群</strong>:科研人員、教育工作者、政策制定者、產業界研發人員、科學新聞工作者等。</li> | ||
| + | <li><strong>投稿門檻</strong>:極高,許多稿件在初審階段就被拒;被接受文章常被視為領域內「突破」或「里程碑」。</li> | ||
| + | </ul> | ||
| + | <h4>七、為何值得關注(對使用者的價值)</h4> | ||
| + | <ul> | ||
| + | <li>能迅速掌握科學前沿:許多關鍵發現會先於其他渠道在 Nature 發表。</li> | ||
| + | <li>跨學科閱讀:適合希望從更宏觀、跨領域角度探知科學進展的讀者。</li> | ||
| + | <li>引用與參考價值高:若您是做研究、教學或報告,Nature 的文章常具高參考價值。</li> | ||
| + | <li>也可用於了解「科學-政策-社會」鏈結,比如科學如何影響政策、社會如何影響科學方向。</li> | ||
| + | </ul> | ||
| + | <h4>八、使用小提醒</h4> | ||
| + | <ul> | ||
| + | <li>因為部分內容在訂閱之後才可完整閱讀,若您所在機構沒有訂閱,可先看「摘要」、「新聞報導」或「開放取得 (Open Access)」文章。</li> | ||
| + | <li>若您想投稿,務必了解該刊對「影響力」和「廣泛關注度」的高要求,準備時要著重研究的新穎性與影響範圍。</li> | ||
| + | <li>在教學/匯報中引用時,也應注意:雖被高度評價,但並不代表所有結果都無可質疑,因此仍應考察研究方法與限制。</li> | ||
| + | </ul> | ||
| + | |||
| + | <h3>[[zhtwwikipedia::粒線體融合|粒線體融合]]與[[zhtwwikipedia::粒線體分裂|粒線體分裂]]</h3> | ||
| + | # <span style='vertical-align:top'>真菌粒線體和過氧化物酶體的分裂。<br/>(a) 粒線體的排列是由動力蛋白介導的融合和分裂事件決定。融合分別由位於粒線體外膜和內膜的動力蛋白Fzo1(粒線體融合蛋白)和Mgm1(Opa1)驅動,而Dnm1則介導分裂。<br/>(b) 過氧化物酶體透過從已存在的細胞器生長和分裂而增殖,此過程也涉及Dnm1。 Dnm1透過與Mdv1銜接蛋白(下圖)的相互作用,被膜受體Fis1募集到粒線體和過氧化物酶體。隨後,Dnm1在細胞器周圍組裝成螺旋狀結構,並在GTP水解時收縮並切斷細胞器膜。過氧化物酶體的分裂之前是細胞器的伸長,而細胞器的伸長是由膜伸長因子Pex11促進的。該蛋白質也可作為 Dnm1 活化劑。<img src='http://urclass.net/files/wikiUsed/Mitochondrial-and-peroxisome-division-in-fungi-a-The-mitochondrial-arrangement-is.png'/></span> | ||
| + | #*[https://www.researchgate.net/figure/Mitochondrial-and-peroxisome-division-in-fungi-a-The-mitochondrial-arrangement-is_fig1_347068284 圖示來源 researchgate] | ||
| + | # 相關蛋白質名稱對照表:<table class='nicetable'> | ||
| + | <tr><th>功能</th><th>哺乳類(mammal)</th><th>酵母(yeast)</th><th>果蠅(Drosophila)</th></tr> | ||
| + | <tr><td>分裂(fission)</td><td><strong>Drp1 / DNM1L</strong></td><td><strong>Dnm1</strong></td><td>'''Drp1'''(也有人稱 Drp1-like)</td></tr> | ||
| + | <tr><td>融合 fusion:外膜(OMM)</td><td><strong>Mfn1 / Mfn2</strong></td><td><strong>Fzo1</strong></td><td><strong>Marf</strong></td></tr> | ||
| + | <tr><td>融合 fusion:內膜(IMM)</td><td><strong>Opa1</strong></td><td><strong>Mgm1</strong></td><td>'''Opa1'''</td></tr> | ||
| + | </table><br/><table class='nicetable'> | ||
| + | <tr><th>構件</th><th>職務簡稱</th><th>模式生物</th></tr> | ||
| + | <tr><td>Fis1</td><td>外膜錨點、把 fission 複合體釘在外膜</td><td>酵母(yeast)</td></tr> | ||
| + | <tr><td>Mdv1</td><td>幫 Dnm1 過來 → 固定 → 組圈圈</td><td>酵母(yeast)</td></tr> | ||
| + | </table> | ||
於 2025年12月9日 (二) 10:04 的最新修訂
- 《Nature》雜誌 2025.7.16 發佈了題為《睡眠驅力來自於粒線體融合》(Mitochondrial origins of the pressure to sleep)的研究報告。
- 久不利多製作的播客解說影片:(來源:Youtube)
Google AI 摘要:
一項來自2025年發表在《自然》雜誌上的關於果蠅(Drosophila)的研究提出:睡眠壓力源自於與有氧代謝相關的粒線體。具體而言,某些睡眠調節神經元內代謝壓力的累積會起到「斷路器」的作用,從而觸發睡眠。
ChatGpt 摘要:
本研究分析果蠅大腦中負責誘發睡眠的特定神經元(dFBNs),比較正常休息與睡眠剝奪後的單細胞轉錄體變化。研究發現:睡眠剝奪後,僅在這一小群睡眠控制神經元中,粒線體呼吸鏈與ATP合成相關的基因大幅上調,而與突觸傳輸相關基因下調。
同步的細胞形態成像顯示:睡眠剝奪會造成粒線體破碎化、粒線體與ER接觸增多、以及粒線體自噬上升,而此現象在恢復睡眠後可逆轉;若提供替代電子流出口或調整粒線體供需,使電子不致「淤積」,則可減輕睡眠壓力。若故意在睡眠神經元中促進粒線體融合會增加睡眠;相反促進粒線體分裂會減少睡眠。
作者提出:睡眠壓力是一種來自「粒線體電子供需不平衡」的訊號:當清醒時,這些睡眠神經元電活動被抑制、ATP消耗少,粒線體卻持續有高電子來源 → 造成電子累積更易外洩成自由基 → 驅動睡眠需求。睡眠讓粒線體得以重新調解、修復、融合與清除受損片段。
總結:
睡眠或許是有氧代謝無可避免的副產品,人類「很想睡」並非心因,而是細胞能量處理的物理後果。
Nature :大腦每日「重啟」的底層程式碼——不是爲了清空記憶體,而是爲了修復能量系統
睡眠壓力的源頭,可能並非來自神經元之間複雜的訊號傳遞,而是深深根植於一個更古老、更核心的生命過程——細胞的能量代謝。
我們為什麼非睡覺不可?
這不是一個哲學問題,而是一個深刻的生物學之謎。我們可以用意志力對抗飢餓,忍受口渴,但幾乎沒人能戰勝強烈的睏意。這種不可抗拒的睡眠需求,我們稱之為「睡眠壓力」 (sleep pressure)。它像一個看不見的計時器,從我們醒來的那一刻開始悄然累積,隨著清醒時間的延長而愈發沉重,直到把我們「壓」回床上。只有通過一場酣暢的睡眠,這個壓力才能被徹底釋放,讓我們在第二天清晨重獲新生。
但這個「壓力」究竟是什麼?它是一種化學物質,還是一種物理狀態?它藏身於大腦的何處,又遵循著怎樣的規則?儘管我們對睡眠的認知已取得長足進步,但睡眠壓力的物理本質,長期以來就像一個幽靈,困擾著神經科學領域。
7月16日,發表在《Nature》上的研究「Mitochondrial origins of the pressure to sleep」,為我們揭開這個謎團提供了革命性的線索。研究團隊以果蠅為模型,展開了一場精彩的分子偵探工作。他們發現,睡眠壓力的源頭,可能並非來自神經元之間複雜的訊號傳遞,而是深深根植於一個更古老、更核心的生命過程——細胞的能量代謝。
具體來說,答案指向了我們細胞內的「能量工廠」——線粒體(mitochondria)。研究指出,在特定睡眠控制神經元中,清醒狀態下積聚的「電子盈餘」 (electron surplus) 才是驅動我們走向睡眠的根本力量。這就像一個能量沙漏,當清醒時「下方」的電子越積越多,就必然需要睡眠這個「翻轉」的動作來讓沙漏重新開始計時。
睡眠債的分子賬本:一張寫在特定神經元里的「收據」
要找到睡眠壓力的源頭,首先要確定「案發地點」。研究人員將目光鎖定在大腦中一群特殊的神經元上。在果蠅的大腦中,有一小群神經元,因其投射到大腦中央一個叫做「扇形體」 (fan-shaped body) 的區域而得名,特別是其背側部分,因此被稱為背側扇形體神經元 (dorsal fan-shaped body neurons, dFBNs)。此前的研究已經證實,這群神經元是調控睡眠的「總開關」:啟用它們會誘導睡眠,而抑制它們則會讓果蠅保持清醒。
如果睡眠壓力真的存在物理實體,那麼在這些關鍵的睡眠控制神經元中,必然會留下它來過的痕跡。爲了捕捉這些痕跡,研究人員採用了單細胞RNA測序 (single-cell RNA sequencing, scRNA-seq),精確地讀出單個細胞中所有基因的「工作狀態」(即基因表達水平),就像為每個細胞製作一張獨一無二的「工作報告」。
研究人員設計了一個巧妙的實驗。他們通過基因工程手段,讓果蠅的 dFBNs 神經元帶上綠色螢光蛋白 (GFP) 標記,這樣在解離大腦後,就能利用流式細胞術 (flow cytometry) 像分揀糖豆一樣,精確地將這些發光的 dFBNs 神經元從數以萬計的其他腦細胞中分離出來。
他們比較了兩組果蠅的大腦:一組是經過充分休息的「精神小夥」,另一組則是被剝奪了12小時睡眠的「瞌睡蟲」。通過對它們大腦中成千上萬個細胞(包括dFBNs和其他型別的神經元)進行測序,一張關於睡眠剝奪的「分子賬本」被清晰地揭示了出來。
結果令人震驚。在絕大多數腦細胞中,睡眠剝奪前後的基因表達變化並不顯著。然而,在 dFBNs 這群關鍵的睡眠控制神經元中,卻出現了天翻地覆的變化。這份「賬本」的兩側寫著截然相反的內容:
在「支出」欄(被下調的基因),大量與突觸功能 (synaptic function) 相關的基因被顯著「關閉」了。這些基因負責神經元之間的資訊傳遞,比如突觸囊泡的釋放、神經遞質的運輸以及突觸結構的組裝。這表明,在睡眠壓力高企時,dFBNs 的對外交流功能被主動抑制了。
在「收入」欄(被上調的基因),幾乎所有被顯著「開啟」的基因,都指向同一個地方——線粒體 (mitochondria)。這些基因編碼的蛋白質,幾乎無一例外地參與線粒體呼吸 (mitochondrial respiration) 和 ATP (三磷酸腺苷) 合成。它們是電子傳遞鏈 (electron transport chain) 複合物I到V的各個亞基,以及三羧酸循環中的關鍵酶。ATP 是細胞的「通用能量貨幣」,而線粒體就是製造這種貨幣的工廠。
這個發現就像在複雜的犯罪現場找到了關鍵物證。它告訴我們,睡眠壓力在 dFBNs 中留下的最深刻印記,並非神經訊號的改變,而是能量代謝系統的劇烈重塑。當果蠅感到睏倦時,它的 dFBNs 神經元內部正在瘋狂地「增產」能量工廠的元件。
更重要的是,這種變化具有高度的特異性。研究人員分析了大腦中其他兩種數量相當的神經元群體——嗅覺系統的投射神經元 (projection neurons) 和學習記憶中樞的 Kenyon 細胞——發現它們在睡眠剝奪后,線粒體相關的基因並沒有出現類似的上調。這排除了「大腦累了,所有細胞都需要更多能量」這種簡單的解釋。恰恰相反,這是一場只在 dFBNs 這群睡眠調控「指揮官」內部上演的特殊風暴。
那麼,新的問題來了:為什麼睡眠壓力會特異性地讓 dFBNs 神經元的線粒體系統「加班加點」?這種基因表達的上調,究竟是爲了彌補某種損耗,還是某種更深層次機制的體現?這個線索,將調查引向了細胞能量代謝的核心。
能量「高速路」大堵車:清醒時「只進不出」的電子盈餘
要理解 dFBNs 內部的這場線粒體風暴,我們需要先了解線粒體是如何工作的。
你可以把線粒體想像成一個精密的能量轉換工廠。食物經過消化分解,最終以高能電子的形式(主要由一種叫做 NADH 的分子攜帶)進入工廠的「生產線」——電子傳遞鏈 (electron transport chain, ETC)。這條生產線由一系列蛋白質複合物(複合物I到IV)組成,它們像傳送帶一樣,將電子一步步傳遞下去。在傳遞過程中,電子的能量被用來將質子 (H+) 從線粒體內膜的一側泵到另一側,建立起一個質子電化學梯度 (proton electrochemical gradient),就像在大壩兩側形成水位差。最終,這些質子通過一個叫做 ATP 合酶 (ATP synthase) 的「渦輪發電機」迴流,驅動其旋轉,從而將 ADP 和磷酸合成為高能的 ATP。而完成了傳遞任務的電子,最終與氧氣結合,產生水。
這是一個高效而有序的過程,但它的順暢執行依賴於一個關鍵前提:電子的供應和 ATP 的消耗需要保持平衡。如果 ATP 的需求量很大(比如神經元在劇烈放電時),「渦輪發電機」就會飛速旋轉,消耗大量質子,從而拉動電子在傳遞鏈上快速流動。反之,如果 ATP 的需求量很小,質子迴流減慢,整個電子傳遞鏈就會像高峰時段的公路一樣,發生「堵車」。
這正是 dFBNs 神經元在清醒時面臨的窘境。此前的研究已經發現,在果蠅清醒時,促進覺醒的神經遞質(如多巴胺)會強烈抑制 dFBNs 的電活動。也就是說,在清醒狀態下,dFBNs 是「沉默」的,它們不怎麼放電,因此消耗的 ATP 非常少。然而,作為一個活細胞,它仍然在從外界攝取營養,這意味著電子(來自NADH)的供應是充足的。
一邊是源源不斷的電子供應(能量高速路的入口車流不息),另一邊是微乎其微的 ATP 消耗(出口收費站幾乎關閉)。結果可想而知:電子傳遞鏈這條「高速路」被堵得水泄不通。當電子無處可去時,它們就會從傳遞鏈的某些環節(主要是複合物I和III)「泄漏」出來,直接與氧分子發生不正當的反應,產生一種極不穩定的、具有高度破壞性的分子——超氧化物 (superoxide),以及其他活性氧形式 (reactive oxygen species, ROS)。
這就是研究人員提出的核心假說:清醒狀態在 dFBNs 中導致了「電子溢出」 (electron overflow),產生了大量的 ROS,而這正是睡眠壓力的分子根源。
這個假說聽起來很有道理,但需要證據。研究人員用一系列巧妙的實驗驗證了它。首先,他們要證明清醒時 dFBNs 的 ATP 消耗確實很低。如果假說成立,那麼由於 ATP 「產大於銷」,細胞內的 ATP 濃度應該會上升。研究人員使用了兩種可以感知 ATP 濃度的螢光探針(iATPSnFR 和 ATeam),在活體果蠅中實時監測 dFBNs 內部的 ATP 水平。結果正如預期:與充分休息的果蠅相比,睡眠剝奪后的果蠅 dFBNs 神經元中的 ATP 濃度確實顯著更高,大約上升了 1.2 倍。相比之下,投射神經元中的 ATP 濃度則沒有變化。這個結果有力地支援了「低消耗導致高庫存」的觀點。
不僅如此,當研究人員用一個溫和的熱刺激(這會啟用釋放多巴胺的神經元,從而抑制dFBNs)來「喚醒」果蠅時,他們觀察到 dFBNs 內的 ATP 濃度出現了瞬間的、急劇的升高。反之,當他們用光遺傳學手段強制啟用 dFBNs,模擬其在睡眠中的放電狀態時,ATP 濃度則應聲下降。
這些證據共同描繪了一幅清晰的圖景:在清醒時,dFBNs 處於一種能量「過飽和」狀態。電子源源不斷地涌入,卻沒有足夠的 ATP 需求來消耗它們,導致電子傳遞鏈「超載」。這種超載狀態就像一個不斷被充氣的氣球,其內部的「壓力」——也就是電子泄漏和 ROS 損傷——持續累積,最終形成了我們所感知的、不可抗拒的睡眠壓力。
黑客帝國:重編睡眠程式的「作弊碼」
如果「電子溢出」真的是睡眠壓力的根源,那麼通過人為干預這個過程,就應該能夠像輸入「作弊碼」一樣,隨心所欲地操縱睡眠。研究人員正是這麼做的,他們上演了一場精彩的「系統破解」,為自己的假說提供了因果性的證明。
作弊碼一:為電子高速路開闢「應急車道」
既然問題出在電子「堵車」,那麼最直接的解決辦法就是疏導交通。研究人員想到了兩種方法。第一種方法是安裝一個「安全出口」。他們利用基因工程,在 dFBNs 的線粒體中引入了一種來自海鞘 (Ciona intestinalis) 的替代氧化酶 (alternative oxidase, AOX)。這種酶非常特別,它可以繞過電子傳遞鏈的後半段,直接接收「堵車」的電子,並將它們與氧氣結合產生水。它相當於為擁堵的電子車流開闢了一條暢通無阻的應急出口,安全地釋放了交通壓力,同時又不會產生 ROS。
結果如何?表達了 AOX 的果蠅,其基礎睡眠時間顯著減少,並且在經歷睡眠剝奪后,它們幾乎不需要「補覺」。這表明,一旦電子溢出的問題被解決,睡眠壓力就無從積累了。第二種方法是增開「出口收費站」。研究人員在 dFBNs 中過表達了一種叫做解偶聯蛋白 (uncoupling protein, Ucp4) 的蛋白質。這種蛋白的作用是線上粒體內膜上形成一個「漏洞」,讓被泵出去的質子可以直接流回,而無需經過 ATP 合酶。這相當於人為地增加了能量消耗,迫使電子傳遞鏈必須加速運轉來維持質子梯度,從而增加了對電子的需求。結果同樣支援了假說:表達了 Ucp4 的果蠅,睡眠時間也顯著減少了。
作弊碼二:製造一場「幽靈堵車」
有疏導,自然也要有添堵。如果能不通過 NADH,而是用其他方式來製造 ATP,那麼原本的電子就變得「多餘」了,電子溢出的問題會更加嚴重。這會直接誘導睡眠嗎?研究人員在 dFBNs 的線粒體中安裝了一個來自古菌的光碟機動質子泵 (light-driven proton pump, delta-rhodopsin)。這個蛋白就像一個微型的太陽能電池板,只要用特定波長的光照射,它就能主動地將質子泵出線粒體內膜,建立起驅動 ATP 合成的質子梯度。這意味著,ATP 的生產可以完全繞開電子傳遞鏈。
實驗結果令人驚歎。當研究人員用綠光照射這些果蠅時,它們幾乎是立刻就陷入了沉睡。在光照的第一個小時內,它們的睡眠時間遠超所有對照組。這就像是憑空製造了巨大的睡眠壓力,讓果蠅不得不立即「還債」。這個實驗證明,dFEBNs 中的電子盈餘,而非能量(ATP)本身的多寡,才是誘導睡眠的關鍵訊號。
作弊碼三:觀察破壞的痕跡
電子溢出產生的 ROS 是具有高度破壞性的「分子流氓」,它們會優先攻擊線粒體膜上的脂質和蛋白質,對線粒體造成損傷。受損的線粒體需要被修復或清除,而這個過程的第一步,往往是線粒體分裂 (mitochondrial fission)。健康的線粒體通常呈細長的管狀網路,而受損的線粒體會斷裂成許多細小的、碎片化的球狀或桿狀結構。
研究人員利用高解析度的顯微鏡技術,觀察了睡眠剝奪前後 dFBNs 神經元中線粒體的形態。他們發現,經過一夜的睡眠剝奪,dFBNs 中的線粒體確實發生了顯著的碎片化:它們變得更小、更圓,數量也更多了。而當這些果蠅被允許「補覺」24小時後,它們的線粒體形態又恢復了健康的長條網路狀。更關鍵的是,這種形態上的變化與電子溢出直接相關。在那些表達了 AOX(安全出口)或被持續啟用(增加ATP消耗)的果蠅中,即使經歷了睡眠剝奪,它們 dFBNs 里的線粒體也依然保持著健康的形態,沒有發生碎片化。
這一系列觀察將分子層面的「電子溢出」與細胞器層面的「形態損傷」緊密地聯繫在了一起。睡眠壓力不僅是一個抽像的概念,它在 dFBNs 內部留下了清晰可見的物理傷痕——破碎的線粒體。
線粒體的「分合之舞」:決定你是精神抖擻還是睡眼惺忪
至此,我們已經有了一條清晰的邏輯鏈:清醒 → dFBNs 被抑制 → ATP 消耗降低 → 電子在 ETC 中「堵車」 → 電子溢出產生 ROS → 線粒體受損併發生分裂(碎片化)。現在,我們面臨最後一個,也是最核心的問題:線粒體的這種形態變化,是如何最終轉化為控制整個機體睡眠行為的命令的?
線粒體的形態並非一成不變,而是在分裂 (fission) 和融合 (fusion) 之間進行著動態的平衡之舞。這個舞蹈由一組特殊的 GTP 酶家族蛋白精確調控。其中,Drp1 蛋白是分裂的主要執行者,它像一個項圈一樣,箍線上粒體上並收緊,最終將其「掐斷」。而 Marf 和 Opa1 蛋白則是融合的關鍵角色,它們分別負責線粒體外膜和內膜的融合,讓兩個線粒體合併成一個。
研究人員猜測,這場「分合之舞」本身,可能就是調節睡眠的「舞步」。如果說線粒體分裂是機體應對睡眠壓力(即電子溢出和損傷)的一種應答,那麼人為地操縱這個過程,應該也能影響睡眠。他們再次動用了基因「手術刀」,在 dFBNs 中強制改變這場舞蹈的節奏。
當強制分裂時:他們過量表達了分裂蛋白 Drp1,或者敲低了融合蛋白 Marf/Opa1。這相當於讓線粒體持續處於碎片化的狀態,模擬的是機體已經「還完睡眠債」並開始修復的訊號。結果出人意料卻又在情理之中:這些果蠅的睡眠時間顯著減少了,並且在睡眠剝奪后幾乎沒有睡眠反彈。這說明,線粒體分裂這個動作,本身就是一種「睡眠壓力已釋放」的訊號。通過人為製造這個訊號,系統被「欺騙」了,認為不再需要睡眠。
當強制融合時:反過來,他們敲低了分裂蛋白 Drp1,或者過量表達了融合蛋白 Marf 和 Opa1。這讓線粒體無法正常分裂,即使在電子溢出和 ROS 損傷不斷累積的情況下,它們也只能「硬扛」,無法啟動修復程式。結果與強制分裂完全相反:這些果蠅的睡眠時間大大增加,睡得更沉,更難被喚醒。這表明,當「壓力釋放」的訊號通路(即線粒體分裂)被阻斷時,睡眠壓力會以前所未有的程度累積,導致機體需要更長、更深的睡眠來償還這筆「巨額債務」。
這些實驗的結果,將線粒體的形態動態與睡眠行為直接掛鉤。但最終的聯繫點在哪裡?答案是神經元的電生理特性 (electrophysiological properties)。研究人員通過活體腦片電生理記錄,直接分析了不同狀態下 dFBNs 的「興奮性」。他們發現,線粒體的形態直接決定了神經元的放電能力:
當線粒體強制融合時(對應高睡眠壓力、長睡眠),dFBNs 變得更易興奮。在注入相同電流的情況下,它們能產生更多、更強的動作電位爆發。而當線粒體強制分裂時(對應低睡眠壓力、短睡眠),dFBNs 的興奮性則顯著降低。
這便是最終的閉環:電子溢出 → 線粒體損傷與分裂 → dFBNs 興奮性降低。等等,這裡似乎有一個矛盾。我們知道,dFBNs 是睡眠誘導神經元,它的興奮(放電)是促進睡眠的。那麼,高睡眠壓力(清醒久了)應該讓它更容易興奮才對,為什麼實驗結果反而是興奮性降低呢?
這裡的邏輯需要仔細梳理。睡眠壓力(電子溢出和線粒體分裂)本身,是一種抑制 dFBNs 功能的訊號,它讓 dFBNs 變得遲鈍,這是機體在清醒時維持覺醒狀態的機制。而睡眠的發生,是當這種壓力累積到一定閾值后,系統發生「相變」,通過某種代償機制(比如,在睡眠期間線粒體融合佔主導),使 dFBNs 的興奮性反彈並超越正常水平,從而觸發強烈的放電,引導機體進入睡眠狀態以進行修復。因此,強制融合的實驗,實際上是模擬了睡眠期間的修復狀態,使得 dFBNs 長期處於高興奮性,從而導致了過度的睡眠。而強制分裂的實驗,則是將 dFBNs 鎖定在了「壓力已釋放」的低興奮性狀態,從而減少了睡眠。
這場線粒體的分合之舞,就這樣通過調控神經元的興奮性,將最微觀的電子流動,最終轉換爲了整個生物體最宏觀的行為節律——睡與醒。
沙漏里的電子:睡眠,一場古老的能量管理藝術
現在,讓我們回到最初的問題:睡眠壓力究竟是什麼?這項研究為我們描繪了一幅前所未有的高清影象。睡眠壓力並非一種神秘的體液或單一的「睡眠因子」,它是一種發生在特定神經元(dFBNs)線粒體中的物理化學過程。它源於清醒狀態下,細胞能量供需的失衡——即電子供應(來自營養)超過了 ATP 需求(來自神經活動)。
這種失衡導致了電子在傳遞鏈上的「交通堵塞」,並最終以活性氧(ROS)的形式「泄漏」出來,對線粒體造成氧化損傷。作為應對,線粒體網路發生分裂和碎片化。而這個由電子溢出驅動的、伴隨著線粒體損傷和形態重塑的過程,其本身,就是睡眠壓力的物理實體。
研究人員在論文的最後,提出了一個極為精妙的比喻:電子在 dFBNs 呼吸鏈中的流動,就像沙子在沙漏中流動一樣。在清醒時,沙子(電子)不斷從上方(NADH)落下,但下方(ATP 需求)的出口卻很小,導致沙子在「腰部」(電子傳遞鏈)堆積。這種堆積(電子溢出)就是睡眠壓力的累積。當堆積達到極限時,唯一的解決辦法就是將沙漏整個「翻轉」過來——這就是睡眠。在睡眠中,dFBNs 開始活躍放電,ATP 需求大增,堆積的沙子得以快速流下,同時啟動線粒體的融合與修復。當沙子流完,壓力就釋放了,新的一天開始了。
這個模型不僅完美地解釋了該研究中的所有實驗數據,更將睡眠置於一個更宏大、更古老的生命背景之下。它告訴我們,睡眠可能並非大腦爲了處理資訊、鞏固記憶等「高級」功能而「發明」的奢侈品,而是有氧代謝 (aerobic metabolism) 這一古老生命策略不可避免的副產品。
有氧呼吸,即利用氧氣作為最終電子受體,能最大限度地從食物中榨取能量,這是地球生命演化史上的一次巨大飛躍,它為複雜多細胞生物的出現奠定了基礎。但凡事皆有代價。高效能量轉換的背後,是電子泄漏和 ROS 損傷的持續風險。
睡眠,或許就是生命爲了管理這一風險,爲了定期清理和修復能量工廠(線粒體)所演化出的終極解決方案。這也能解釋為什麼睡眠問題與許多代謝相關疾病,如神經退行性疾病、代謝綜合徵等,有著千絲萬縷的聯繫——它們的共同點,都指向了線粒體功能障礙和氧化應激。
從果蠅大腦深處的一群神經元,到細胞內微小的線粒體,再到奔流不息的電子,這項研究帶領我們完成了一次跨越多個尺度、激動人心的科學探索。它揭示了,驅動我們日復一日沉入夢鄉的,或許正是那流淌在生命最核心能量中樞里,如沙漏般精準計時的,無形的電子。睡眠,原來是一場如此古老而深刻的能量管理藝術。
版權聲明 本網站所有註明「來源:生物谷」或「來源:bioon」的文字、圖片和音視訊資料,版權均屬於生物谷網站所有。非經授權,任何媒體、網站或個人不得轉載,否則將追究法律責任。取得書面授權轉載時,須註明「來源:生物谷」。其它來源的文章系轉載文章,本網所有轉載文章系出於傳遞更多資訊之目的,轉載內容不代表本站立場。不希望被轉載的媒體或個人可與我們聯繫,我們將立即進行刪除處理。
參考資料:
- 報告,Nature 官網下載點
- 粒線體融合
- 神經元凋亡過程中粒線體衰變的調控(德文),原文出處,第10頁有粒線體被 Drp1 收縮致分裂的圖示
- 粒線體(法文),第5頁有粒線體被 Drp1 收縮致分裂的圖示
Nature
一、期刊簡介
- 《Nature》創刊於 1869 年,是一本國際知名、綜合型的週刊科學期刊。
- 出版商為 Nature Portfolio,隸屬於 Springer Nature 集團。
二、定位與宗旨
- Nature 標榜「世界領先的跨學科科學期刊」:刊登具重大影響力、跨領域、原創性研究成果。
- 它不僅刊登研究文章,也包括評論 (Review)、專題報導、科學新聞、分析文章與社論等。Nature
- 其審稿與選稿標準非常嚴格:一般提交率極高、接受率低,以保證「突破性」與「廣泛影響力」為目標。
三、歷史沿革
- 創刊於 1869 年11月4日,由英國創立,旨在提供一個科學成果與討論的公開平台。
- 隨著時間推移,逐步擴展為擁有多個專門分支期刊 (例如 Nature Physics、Nature Biotechnology 等)的出版集團。
- 從紙本轉向網路版,並且涵蓋科研、新聞、評論、網路媒體等多種形式。
四、期刊影響 & 在學界的重要性
- Nature 是全球被引用率極高的科學期刊之一,其影響力在學術界被視為極具指標性。
- 因為其高度競爭的審稿流程,被錄用於 Nature 的文章往往被視為「重大突破」。維基百科
- 儘管如此,也有學界對於高影響力期刊的可靠性、偏好性等提出批評。arXiv
五、內容與版塊特色
- 研究論文 (Articles/Letters):Nature 的核心內容,多為具新穎性與廣泛影響的原創科研成果。Nature
- 新聞與評論 (News & Comment):科學政策、資金、倫理、社會影響等議題的報導與分析。
- 專欄與解說 (News & Views, Reviews):對某一領域或研究進展的綜述與深入解釋。
- 補充與拓展渠道:除了主刊以外,Nature 系列還包括多個專業子刊 (如 Nature Genetics、Nature Physics…)。維基百科
六、投稿與讀者群
- 投稿人:主要為全球各領域(物理、生物、地球科學、醫學、材料科學等)的研究學者。
- 讀者群:科研人員、教育工作者、政策制定者、產業界研發人員、科學新聞工作者等。
- 投稿門檻:極高,許多稿件在初審階段就被拒;被接受文章常被視為領域內「突破」或「里程碑」。
七、為何值得關注(對使用者的價值)
- 能迅速掌握科學前沿:許多關鍵發現會先於其他渠道在 Nature 發表。
- 跨學科閱讀:適合希望從更宏觀、跨領域角度探知科學進展的讀者。
- 引用與參考價值高:若您是做研究、教學或報告,Nature 的文章常具高參考價值。
- 也可用於了解「科學-政策-社會」鏈結,比如科學如何影響政策、社會如何影響科學方向。
八、使用小提醒
- 因為部分內容在訂閱之後才可完整閱讀,若您所在機構沒有訂閱,可先看「摘要」、「新聞報導」或「開放取得 (Open Access)」文章。
- 若您想投稿,務必了解該刊對「影響力」和「廣泛關注度」的高要求,準備時要著重研究的新穎性與影響範圍。
- 在教學/匯報中引用時,也應注意:雖被高度評價,但並不代表所有結果都無可質疑,因此仍應考察研究方法與限制。
粒線體融合與粒線體分裂
- 真菌粒線體和過氧化物酶體的分裂。
(a) 粒線體的排列是由動力蛋白介導的融合和分裂事件決定。融合分別由位於粒線體外膜和內膜的動力蛋白Fzo1(粒線體融合蛋白)和Mgm1(Opa1)驅動,而Dnm1則介導分裂。
(b) 過氧化物酶體透過從已存在的細胞器生長和分裂而增殖,此過程也涉及Dnm1。 Dnm1透過與Mdv1銜接蛋白(下圖)的相互作用,被膜受體Fis1募集到粒線體和過氧化物酶體。隨後,Dnm1在細胞器周圍組裝成螺旋狀結構,並在GTP水解時收縮並切斷細胞器膜。過氧化物酶體的分裂之前是細胞器的伸長,而細胞器的伸長是由膜伸長因子Pex11促進的。該蛋白質也可作為 Dnm1 活化劑。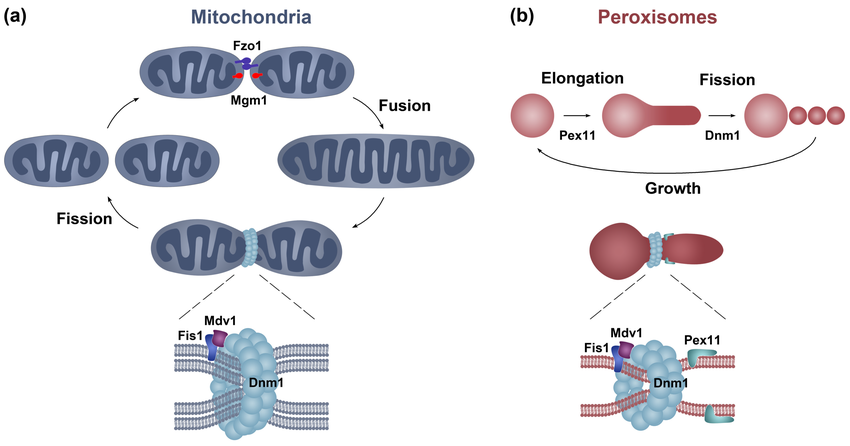
- 相關蛋白質名稱對照表:
功能 哺乳類(mammal) 酵母(yeast) 果蠅(Drosophila) 分裂(fission) Drp1 / DNM1L Dnm1 Drp1(也有人稱 Drp1-like) 融合 fusion:外膜(OMM) Mfn1 / Mfn2 Fzo1 Marf 融合 fusion:內膜(IMM) Opa1 Mgm1 Opa1 構件 職務簡稱 模式生物 Fis1 外膜錨點、把 fission 複合體釘在外膜 酵母(yeast) Mdv1 幫 Dnm1 過來 → 固定 → 組圈圈 酵母(yeast)